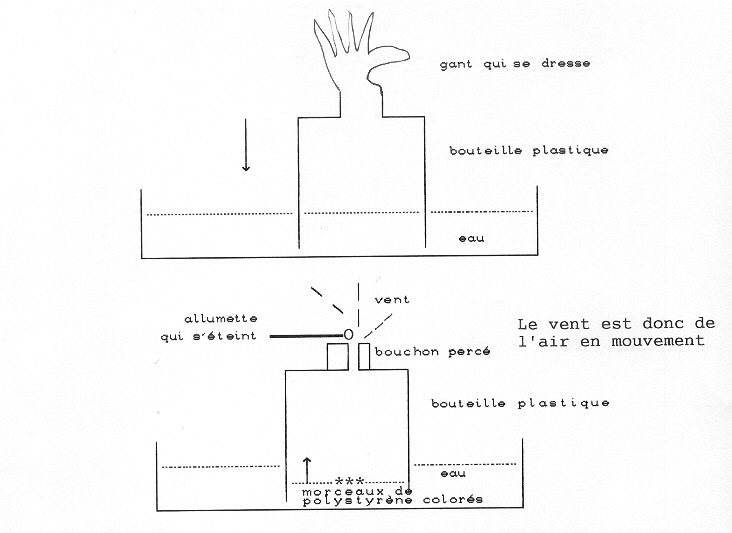

Si on enlève le doigt, le niveau de l’eau dans la bouteille monte de façon à obéir au principe des vases communiquant (niveau égal partout) : on entend un soufle (vent) qui peut éteindre une allumette allumée.
Si on immerge complètement dans l'eau un verre vide retourné ayant un morceau de tissu de collé au fond, quand on le ressort, on constate que le tissu est resté sec. L'air bloqué au fond du verre a empêché l'eau d'atteindre le tissu.
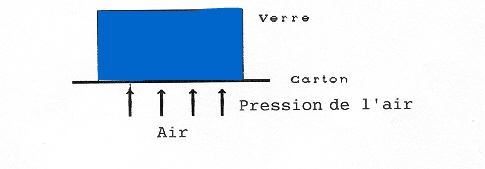
Un verre plein d’eau retourné et fermé par un carton met en évidence l’air en dessous qui maintient l’eau et le carton en place. Dans le vide, le carton ne tiendrait pas.
III- CONSTITUTION ATOMIQUE ET MOLÉCULAIRE DES CORPS
Rappelons ce qui a été dit au I : Hypothèse de NEWTON reprenant les idées des grecs DÉMOCRITE, LEUCIPPE, EPICURE, et du poète romain LUCRÈCE : Il n’y a que des atomes et du vide. Dans la théorie atomique, le vide est aussi important que les atomes.
Citons ici Newton :
“Il me paraît très probable que Dieu forma au commencement la matière de particules solides, pesantes, dures, impénétrables, mobiles, de telles grosseurs, figures, et autres propriétés, en tel nombre et en telle proportion à l’espace qui convenait le mieux à la fin qu’il se proposait; par cela même que, ces particules primitives sont solides, et incomparablement plus dures qu’aucun des corps qui en sont composés, et si dures qu’elles ne s’usent et ne se rompent jamais, rien n’étant capable (suivant le cours ordinaire de la Nature) de diviser ce qui a été primitivement uni par Dieu même. Tant que ces particules restent entières, elles peuvent former des corps de même essence et de même contexture. Mais si elles venaient à s’user ou à se briser, l’essence des choses, qui dépend de la structure primitive de ces particules, changerait infalliblement. L’eau et la terre, composées de vieilles particules usées ou de fragments de ces particules, ne seraient plus cette eau et cette terre primitivement composées de particules entières. Pour que l’ordre des choses puisse être constant, l’altération des corps ne doit donc consister qu’en séparations, nouvelles combinaisons, et mouvements de ces particules : car si les corps se rompent, ce n’est point à travers ces particules solides, inaltérables; c’est aux endroits de leurs jonctions, où elles ne se touchent que par un petit nombre de points”.
“Dans tous les cas, la marche de la Nature est donc très simple et toujours conforme à elle-même : puisqu’elle produit tous les grands mouvements des corps célestes, par la gravitation ou l’attraction réciproque de ces corps; et presque tous les petits mouvements des particules des corps, par d’autres forces attractives et répulsives, réciproques entre ces particules (...). Les petites particules des corps n’ont-elles pas certaines puissances, vertus, ou forces par lesquelles elles agissent à distance (...) les unes sur les autres pour produire une grande partie des phénomènes de la nature? Car il est bien connu que les corps agissent les uns sur les autres par les attractions de la gravité, du magnétisme et de l’électricité; et ces instances montrent la trame et le cours de la nature. Aussi n’est-il pas improbable qu’il y ait d’autres forces attractives en plus. de celles-ci. Car la Nature est très conséquente et très conforme à elle-même”.
Cette théorie explique que les substances comme l’eau ne vieillissent pas étant composées de corps invariables. L’eau ne s’use pas. Même vieille de milliards d’années, elle est toujours identique à elle-même.
L’eau est constituée de “grains”tous identiques appelés molécules d’eau. La molécule d’eau :
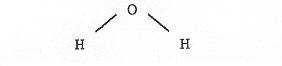
constituée de deux atomes d’hydrogène et d’un atome d’oxygène a une forme propre. Les distances des atomes entre eux sont fixées, l’angle des liaisons O-H aussi. Par conséquent, la molécule d’eau est un corps solide.
L’intérêt de l’explication des trois états de la matière par la théorie atomique est donc de ramener ces trois états : solide, liquide, gaz à un seul état, l’état solide.
Pour voir comment cela est possible, nous allons prendre l’analogie d’un solide en poudre.
IV DIFFÉRENCES ET RESSEMBLANCES ENTRE UN SOLIDE EN POUDRE ET UN LIQUIDE
Un solide en poudre comme du sable fin coule comme un liquide. Il présente également une surface libre. On peut également enfoncer un objet à l’intérieur, de la même manière qu’on peut plonger un objet et l’immerger dans un liquide. Un solide en poudre est pesant, par le caractère pesant des grains. De la même manière, un liquide pèse par le poids de ses molécules. Toutes ces propriétés se comprennent bien par le comportement collectif des grains solides et pesant constituant le corps que ce soit un solide en poudre ou un liquide. Voyons maintenant les différences qui existent entre un solide en poudre et un liquide, et essayons de les comprendre par les propriétés spécifiques des molécules d’un liquide.
1- Un liquide passe à travers un papier filtre (filtre à café), un solide en poudre non.
2- Un liquide a une surface libre horizontale, un solide en poudre non.
3- La plupart des liquides sont transparents.
4- Certains liquides s’évaporent.
5- Les objets flottent ou coulent dans un liquide. Dans, un solide en poudre, ils ne coulent pas.
6- Un liquide peut se congeler en solide lorsqu’on le refroidit.
1- Un papier filtre possède des trous très petits (quelques microns). Il faut donc considérer que les molécules qui constituent un liquide sont très petites, plus petites que ces trous. Typiquement, les dimensions sont de quelques Angström (1 Å= 1/10 000 micron ).
2- Secouons avec un mouvement de vibration un récipient de sable, la surface devient horizontale. On peut donc supposer, ce qui est la réalité, que les molécules sont animées d’un mouvement incessant. Ce mouvement, appelé agitation thermique augmente avec la température, et la température “est”ce mouvement, au niveau microscopique. Un liquide comme l’huile, est en effet moins visqueux quand on le chauffe et sa surface libre se met plus vite à l’horizontale, parce que ses molécules s’agitent plus vite. C'est pour la même raison qu'un fer à repasser glisse sur le linge quand il est chaud, et frotte quand il est froid. Au froid absolu -273 0C, cette agitation s’arrête. Pouvant toujours augmenter plus, il n’y a pas de température maximale.
L’agitation thermique fut découverte en 1827 par BROWN, d’où le nom de mouvement brownien : de petites sphères de polystyrène
de diamètres 1 micron plongées dans de l'eau son vues, avec un microscope, animées d’un mouvement désordonné incessant à cause de leurs
chocs avec les molécules.
Frottons deux objets l’un contre l’autre ou tordons plusieurs fois de suite une tige de métal, il y a échauffement. Cet échauffement correspond à la mise en vibration des molécules.
Ce mouvement ne disparaît pas par frottement, car le frottement chauffe les corps, transformant un mouvement d’un corps de grande dimensions en vibration des molécules. Il y a conservation du mouvement totale, ce qui est la conservation de l’énergie. Comme il n’y a rien de plus petit que la molécule, ce mouvement ne peut pas disparaître, à moins d’être communiqué à d’autres molécules (refroidissement par contact) ou aux photons, grains de lumière (refroidissement par rayonnement).
La propriété d’horizontalité de la surface libre se manifeste même si les deux parties du liquide sont reliées uniquement par un tuyau. On obtient le principe des vases communiquants. Cette égalité des niveaux se manifeste même si les deux parties du tuyau ont des surfaces différentes. Elle est due à l’action de la gravité. C’est pour cette position que le centre de gravité de l’ensemble est le plus bas. Le niveau à bulle fonctionne sur le même principe.
3- La lumière traverse les liquides, car les molécules sont plus petites que la longueur d’onde de la lumière.
4- L’agitation des molécules de la surface peut les amener à se décrocher et à partir seules. C’est l’évaporation qui augmente avec la température.
5- Dans un solide en poudre, ces mouvements sont empéchés par les frottements, dont on a vu qu’ils n’existent pas dans un liquide. Si on agite le solide en poudre et si on le fait vibrer, les objets flotteront ou coulerons. Ainsi, une balle de ping-pong remontera à la surface d’un tas de sable si on secoue celui-ci. Un morceau de plomb au contraire coulera.
6- Contrairement aux grains du solide en poudre, les molécules s’attirent avec des forces très grandes pour leur dimensions. Ces forces les font s’accrocher les une aux autres, on a un solide. Si l’agitation thermique augmente, les molécules peuvent glisser les une sur les autres en restant très proches, bien qu’elles se soient un peu écartées. On a un liquide. Ce phénomène est la fusion. Enfin, si l’agitation augmente les molécules se séparent et se déplacent seules. On a un gaz. L’attraction des molécules, due aux électrons qui les constituent, est d’origine électrostatique, comme l’attraction de petits bouts de papiers par une règle frottée.
On peut obtenir la transformation liquide  solide avec du sable. Il suffit de le mouiller. Le sable mouillé a une
forme propre : chateaux de sables. En effet, l’eau entre les grains, grâce aux forces de capillarité dues à
l’attraction des molécules, joue le rôle de ciment, donc de force assurant l’attraction des “molécules”grains de
sable.
solide avec du sable. Il suffit de le mouiller. Le sable mouillé a une
forme propre : chateaux de sables. En effet, l’eau entre les grains, grâce aux forces de capillarité dues à
l’attraction des molécules, joue le rôle de ciment, donc de force assurant l’attraction des “molécules”grains de
sable.
V DIFFÉRENCES ET RESSEMBLANCES ENTRE UN LIQUIDE ET UN GAZ
1- Un liquide est incompressible, un gaz compressible
2- Un liquide est lourd (dense), un gaz est léger
3- Un liquide est un bon conducteur thermique, un gaz est un isolant
4- Un liquide a une surface libre, un gaz n’en a pas
1- Cette propriété se met bien en évidence avec l’expérience déjà décrite où on enfonce le piston d’une seringue bouchée. Dans le cas du gaz, les molécules sont loins les unes des autres et on peut donc les rapprocher en diminuant le volume. Dans le cas du liquide, les molécules pratiquement en contact ne peuvent être rapprochées.