Richard P. Feynman : “Si toute la connaissance scientifique disparaissait dans un cataclysme, quelle phrase unique pourrait préserver le maximum d’information pour les générations futures? Comment pourrions-nous leur transmettre au mieux notre compréhension du monde? Je propose : “Toutes choses sont faites d’atomes, petites particules animées d’un mouvement incessant, qui s’attirent lorsqu’elle sont distantes les unes des autres, mais se repoussent lorsqu’on les force à se serrer trop près.”Cette seule phrase contient, vous le verrez, une quantité énorme d’information sur le monde, pour peu que l’on y mette un peu d’imagination et de réflexion”.
I- LA MATIÈRE
On peut donner comme définition de la matière : tout ce qui est pesant, c’est la position officielle du programme de l’école primaire, et on ne doit peser l’air qu’à partir du cycle 3. Mais il existe des particules qui ne constituent pas la matière et qui ont cependant une masse (les bosons W+ , W- et Z0 ). De plus, toutes les particules, même celles qui ont une masse nulle, sont sensibles à la gravitation.
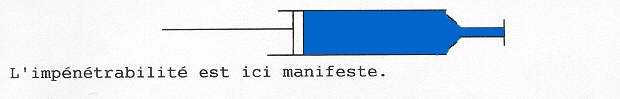
En physique, les particules de matière (électron, proton etc) obéissent au principe d’exclusion de Pauli, dont l’interprétation revient à dire que la matière “tient sa place”et est impénétrable. Ainsi un électron ne peut aller dans une région déjà occupée par un autre électron dans le même état quantique.
Ainsi, le meilleur exemple de matière est un solide comme une table, qui résiste à la pénétration : ainsi un objet ne peut passer à travers la table.
Au 17e siècle, il y eut, avec NEWTON, un renouveau de l’atomisme en Angleterre, tandis qu’en France, la physique piétinait avec Descartes.
L’atomisme se résume en disant que l’univers est constitué d’atomes et de vide, le vide étant dans cette théorie, aussi important que les atomes. Cette théorie provient de l’intuition des grecs LEUCIPPE et DÉMOCRITE. Mais, NEWTON, reprenant cette théorie philosophique et l’intégrant dans une théorie mathématique avec la gravitation universelle (Principia mathematica 1687) qui permet de confronter les résultats avec l’expérience, en fit la première théorie de physique moderne. NEWTON considère que la chose la plus fondamentale est l’étendue du vide, et Dieu est omniprésent dans le vide. “God is as far as vacuum extends”Dieu est infini comme l’espace, il habite le vide. La matière est alors considérée comme du vide rendu impénétrable par Dieu. Les corps ne sont que des espaces où Dieu a interdit la pénétration. Cette géniale intuition rejoint la physique moderne où on considère les particules de matière comme des excitations de champs quantiques dans le vide (théorie quantique des champs) obéissant au principe d’exclusion de PAULI.
Considérant cette définition de la matière il nous reste à voir comment la matière, sous forme liquide ou gazeuse est encore de la matière, c’est à dire présente encore un caractère d’impénétrabilité.
II- LES SOLIDES, LES LIQUIDES, ET LES GAZ
1- Définition
Solide : qui a une forme propre. La distance de deux point du solide reste invariable.
Liquide : Prend la forme du récipient, surface libre plane et horizontale.
Gaz : Occupe tout le volume disponible, sauf pour l’atmosphère retenue autour de la Terre par la gravité. Donc, pas de surface libre.
2- Impénétrabilité des liquides et des gaz
Le sable est constitué de grains solides, mais on peut enfouir un caillou dedans car les grains de sable peuvent s’écarter sur son passage. De même, bien que les liquides et les gaz soient constitués de matière impénétrable, cette matière s’écartant au passage d’un objet, les objets peuvent se déplacer dedans. Mais, enfermons de l’eau dans une seringue et bouchons l’extrémité. Il devient impossible d’enfoncer le piston. L’eau est incompressible, ou pratiquement incompressible.

Remplaçons l’eau par un gaz, comme de l’air, on peut alors enfoncer le piston, mais cela devient de plus en plus dur. Il y a résistance. Si on lache le piston, il repart en arrière avec un phénomène d’élasticité. L'air est impénétrable mais compressible. On voit sur l'animation que la coloration du gaz (dioxyde d'azote) augmente quand on le compresse, ce qui correspond à une plus grande densité de molécules.

3- Autres expériences mettant en évidence l’air immobile

Si il y a un trou, cela fait des bulles dans l’eau et le le piston (2) ne bouge plus.

Si on enlève le doigt, le niveau de l’eau dans la bouteille monte de façon à obéir au principe des vases communiquant (niveau égal partout) : on entend un soufle (vent) qui peut éteindre une allumette allumée.
Si on immerge complètement dans l'eau un verre vide retourné ayant un morceau de tissu de collé au fond, quand on le ressort, on constate que le tissu est resté sec. L'air bloqué au fond du verre a empêché l'eau d'atteindre le tissu.
Un verre plein d’eau retourné et fermé par un carton met en évidence l’air en dessous qui maintient l’eau et le carton en place. Dans le vide, le carton ne tiendrait pas.

III- CONSTITUTION ATOMIQUE ET MOLÉCULAIRE DES CORPS
Rappelons ce qui a été dit au I : Hypothèse de NEWTON reprenant les idées des grecs DÉMOCRITE, LEUCIPPE, EPICURE, et du poète romain LUCRÈCE : Il n’y a que des atomes et du vide. Dans la théorie atomique, le vide est aussi important que les atomes.
Citons ici Newton :
“Il me paraît très probable que Dieu forma au commencement la matière de particules solides, pesantes, dures, impénétrables, mobiles, de telles grosseurs, figures, et autres propriétés, en tel nombre et en telle proportion à l’espace qui convenait le mieux à la fin qu’il se proposait; par cela même que, ces particules primitives sont solides, et incomparablement plus dures qu’aucun des corps qui en sont composés, et si dures qu’elles ne s’usent et ne se rompent jamais, rien n’étant capable (suivant le cours ordinaire de la Nature) de diviser ce qui a été primitivement uni par Dieu même. Tant que ces particules restent entières, elles peuvent former des corps de même essence et de même contexture. Mais si elles venaient à s’user ou à se briser, l’essence des choses, qui dépend de la structure primitive de ces particules, changerait infalliblement. L’eau et la terre, composées de vieilles particules usées ou de fragments de ces particules, ne seraient plus cette eau et cette terre primitivement composées de particules entières. Pour que l’ordre des choses puisse être constant, l’altération des corps ne doit donc consister qu’en séparations, nouvelles combinaisons, et mouvements de ces particules : car si les corps se rompent, ce n’est point à travers ces particules solides, inaltérables; c’est aux endroits de leurs jonctions, où elles ne se touchent que par un petit nombre de points”.
“Dans tous les cas, la marche de la Nature est donc très simple et toujours conforme à elle-même : puisqu’elle produit tous les grands mouvements des corps célestes, par la gravitation ou l’attraction réciproque de ces corps; et presque tous les petits mouvements des particules des corps, par d’autres forces attractives et répulsives, réciproques entre ces particules (...). Les petites particules des corps n’ont-elles pas certaines puissances, vertus, ou forces par lesquelles elles agissent à distance (...) les unes sur les autres pour produire une grande partie des phénomènes de la nature? Car il est bien connu que les corps agissent les uns sur les autres par les attractions de la gravité, du magnétisme et de l’électricité; et ces instances montrent la trame et le cours de la nature. Aussi n’est-il pas improbable qu’il y ait d’autres forces attractives en plus. de celles-ci. Car la Nature est très conséquente et très conforme à elle-même”.
Cette théorie explique que les substances comme l’eau ne vieillissent pas étant composées de corps invariables. L’eau ne s’use pas. Même vieille de milliards d’années, elle est toujours identique à elle-même.
L’eau est constituée de “grains”tous identiques appelés molécules d’eau. La molécule d’eau :
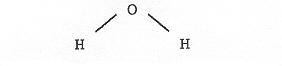
constituée de deux atomes d’hydrogène et d’un atome d’oxygène a une forme propre. Les distances des atomes entre eux sont fixées, l’angle des liaisons O-H aussi. Par conséquent, la molécule d’eau est un corps solide.
L’intérêt de l’explication des trois états de la matière par la théorie atomique est donc de ramener ces trois états : solide, liquide, gaz à un seul état, l’état solide.
Pour voir comment cela est possible, nous allons prendre l’analogie d’un solide en poudre.
IV DIFFÉRENCES ET RESSEMBLANCES ENTRE UN SOLIDE EN POUDRE ET UN LIQUIDE
Un solide en poudre comme du sable fin coule comme un liquide. Il présente également une surface libre. On peut également enfoncer un objet à l’intérieur, de la même manière qu’on peut plonger un objet et l’immerger dans un liquide. Un solide en poudre est pesant, par le caractère pesant des grains. De la même manière, un liquide pèse par le poids de ses molécules. Toutes ces propriétés se comprennent bien par le comportement collectif des grains solides et pesant constituant le corps que ce soit un solide en poudre ou un liquide. Voyons maintenant les différences qui existent entre un solide en poudre et un liquide, et essayons de les comprendre par les propriétés spécifiques des molécules d’un liquide.
1- Un liquide passe à travers un papier filtre (filtre à café), un solide en poudre non.
2- Un liquide a une surface libre horizontale, un solide en poudre non.
3- La plupart des liquides sont transparents.
4- Certains liquides s’évaporent.
5- Les objets flottent ou coulent dans un liquide. Dans, un solide en poudre, ils ne coulent pas.
6- Un liquide peut se congeler en solide lorsqu’on le refroidit.
1- Un papier filtre possède des trous très petits (quelques microns). Il faut donc considérer que les molécules qui constituent un liquide sont très petites, plus petites que ces trous. Typiquement, les dimensions sont de quelques Angström (1 Å= 1/10 000 micron ).
2- Secouons avec un mouvement de vibration un récipient de sable, la surface devient horizontale. On peut donc supposer, ce qui est la réalité, que les molécules sont animées d’un mouvement incessant. Ce mouvement, appelé agitation thermique augmente avec la température, et la température “est”ce mouvement, au niveau microscopique. Un liquide comme l’huile, est en effet moins visqueux quand on le chauffe et sa surface libre se met plus vite à l’horizontale, parce que ses molécules s’agitent plus vite. C'est pour la même raison qu'un fer à repasser glisse sur le linge quand il est chaud, et frotte quand il est froid. Au froid absolu -273 0C, cette agitation s’arrête. Pouvant toujours augmenter plus, il n’y a pas de température maximale.
L’agitation thermique fut découverte en 1827 par BROWN, d’où le nom de mouvement brownien : de petites sphères de polystyrène
de diamètres 1 micron plongées dans de l'eau son vues, avec un microscope, animées d’un mouvement désordonné incessant à cause de leurs
chocs avec les molécules.
Frottons deux objets l’un contre l’autre ou tordons plusieurs fois de suite une tige de métal, il y a échauffement. Cet échauffement correspond à la mise en vibration des molécules.
Ce mouvement ne disparaît pas par frottement, car le frottement chauffe les corps, transformant un mouvement d’un corps de grande dimensions en vibration des molécules. Il y a conservation du mouvement totale, ce qui est la conservation de l’énergie. Comme il n’y a rien de plus petit que la molécule, ce mouvement ne peut pas disparaître, à moins d’être communiqué à d’autres molécules (refroidissement par contact) ou aux photons, grains de lumière (refroidissement par rayonnement).
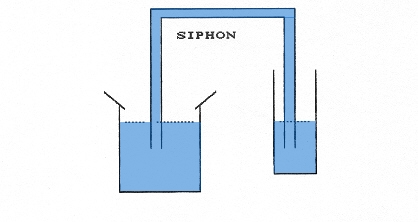
La propriété d’horizontalité de la surface libre se manifeste même si les deux parties du liquide sont reliées uniquement par un tuyau. On obtient le principe des vases communiquants. Cette égalité des niveaux se manifeste même si les deux parties du tuyau ont des surfaces différentes. Elle est due à l’action de la gravité. C’est pour cette position que le centre de gravité de l’ensemble est le plus bas. Le niveau à bulle fonctionne sur le même principe.
3- La lumière traverse les liquides, car les molécules sont plus petites que la longueur d’onde de la lumière.
4- L’agitation des molécules de la surface peut les amener à se décrocher et à partir seules. C’est l’évaporation qui augmente avec la température.
5- Dans un solide en poudre, ces mouvements sont empéchés par les frottements, dont on a vu qu’ils n’existent pas dans un liquide. Si on agite le solide en poudre et si on le fait vibrer, les objets flotteront ou coulerons. Ainsi, une balle de ping-pong remontera à la surface d’un tas de sable si on secoue celui-ci. Un morceau de plomb au contraire coulera.
6- Contrairement aux grains du solide en poudre, les molécules s’attirent avec des forces très grandes pour leur dimensions. Ces forces les font s’accrocher les une aux autres, on a un solide. Si l’agitation thermique augmente, les molécules peuvent glisser les une sur les autres en restant très proches, bien qu’elles se soient un peu écartées. On a un liquide. Ce phénomène est la fusion. Enfin, si l’agitation augmente les molécules se séparent et se déplacent seules. On a un gaz. L’attraction des molécules, due aux électrons qui les constituent, est d’origine électrostatique, comme l’attraction de petits bouts de papiers par une règle frottée.
On peut obtenir la transformation liquide  solide avec du sable. Il suffit de le mouiller. Le sable mouillé a une
forme propre : chateaux de sables. En effet, l’eau entre les grains, grâce aux forces de capillarité dues à
l’attraction des molécules, joue le rôle de ciment, donc de force assurant l’attraction des “molécules”grains de
sable.
solide avec du sable. Il suffit de le mouiller. Le sable mouillé a une
forme propre : chateaux de sables. En effet, l’eau entre les grains, grâce aux forces de capillarité dues à
l’attraction des molécules, joue le rôle de ciment, donc de force assurant l’attraction des “molécules”grains de
sable.
V DIFFÉRENCES ET RESSEMBLANCES ENTRE UN LIQUIDE ET UN GAZ
1- Un liquide est incompressible, un gaz compressible
2- Un liquide est lourd (dense), un gaz est léger
3- Un liquide est un bon conducteur thermique, un gaz est un isolant
4- Un liquide a une surface libre, un gaz n’en a pas
1- Cette propriété se met bien en évidence avec l’expérience déjà décrite où on enfonce le piston d’une seringue bouchée. Dans le cas du gaz, les molécules sont loins les unes des autres et on peut donc les rapprocher en diminuant le volume. Dans le cas du liquide, les molécules pratiquement en contact ne peuvent être rapprochées.
2- Sur une balance, on peut mettre un récipient en plastique de 1,1 l dans lequel on peut faire le vide avec une pompe (conservateur sous vide). On observe une diminution de la masse de 1,3 g .Donc, 1 l d’air pèse environ 1,2 g .
Une rondelle de papier circulaire un peu plus petite que le fond du récipient tombe lentement quand il y a de l’air, et rapidement quand le vide est fait.
Les molécules d’air et d’eau pèsent à peu près le même poids. Donc, si le gaz est beaucoup plus léger (1000 fois, car
1 l d’eau pèse 1 kg), c’est parce qu’il y a moins de molécules, parce qu’elles sont loin les unes des autres dans
un gaz, et c'est pout cette raison que le gaz est compressible. On peut diminuer le volume en rapprochant les molécules.
Dans le cas d'un liquide, les molécules sont en contact, et il est incompressible. On peut calculer que pour qu’il y ait 1000 fois moins de molécules,
il faut que leur espacement
soit multiplié par 10. Ainsi, dans l’air, les molécules sont séparées par une distance égale à 10 fois leur
diamètre. Notons que l'air est plus léger que l'eau pour le même volume. Une goutte d'eau est plus légère que tout l'air
dans une pièce. Il faut donc dire : l'air est moins dense que l'eau. Avec les unités légales, la masse volumique de l'air est
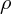 = 1.2 kg/m3. Retour expérience de la compressibilité de l'air.
= 1.2 kg/m3. Retour expérience de la compressibilité de l'air.
On peut remplacer cette expérience par un paquet de café sous vide que l’on perce, ou un ballon de football que l’on
gonfle.
3- Mettons un glaçon en présence d’air à 200C et un glaçon dans de l’eau à 200C. Le glaçon font beaucoup plus vite dans l’eau que dans l’air, ce qui montre que l’eau est un conducteur thermique, tandis que l’air est un isolant. Puisqu’il n’y a que des molécules et du vide, et que c’est le contact d’un corps chaud à 200C qui fait fondre le glaçon (dans le vide, il n’y a pas de température), ce contact ne peut être assuré que par les molécules qui entourent le glaçon. Il y en a bien sûr beaucoup plus dans le cas de l’eau que de l’air, toujours pour la même raison.
Le meilleur isolant thermique est le vide. Ce n’est pas un isolant parfait, car l’énergie peut être transportée dans le vide par rayonnement (C’est ainsi que le Soleil chauffe la Terre). Plaçons dans deux récipients identiques deux glaçons posés sur du polystyrène. Dans un des deux récipients, on fait le vide. Dans ce dernier, le glaçon doit fondre plus lentement.
4- Dans le cas de l’eau ou d’un liquide, les molécules se rassemblent en se mettant en contact et occupent un volume égal au volume total des molécules. Le reste du récipient est vide, les deux milieux étant séparés par la surface libre du liquide. Dans le cas d’un gaz, les molécules libres et isolées se promènent dans tout le volume.
On peut se demander comment toutes ces molécules du gaz, pesantes, ne tombent pas au fond en se rassemblant comme pour un liquide. Elles échappent à la pesanteur. C’est tout simplement leur mouvement incessant qui les relance en permanence vers le haut dans un ballet incessant, comme des insectes volant près d’une lampe. On peut ainsi avoir un ordre de grandeur de la vitesse des molécules d’air. Qu’il y ait beaucoup d’air ou non, l’atmosphère aura toujours un ordre de grandeur de 10 km d’épaisseur. Dans le cas d’une atmosphère peut dense, les molécules ne se cognent plus. Une molécule donnée monte puis redescend de 10 km. Au sol, la vitesse moyenne est du même ordre que la vitesse d’un caillou qui tomberait dans le vide de 10 km, soit :
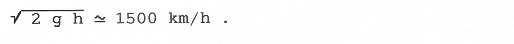

VI- L’ÉQUILIBRE THERMIQUE
Lorsque deux corps à des températures différentes sont mis en contact, leurs températures finissent par s’équilibrer, le corps chaud réchauffant le corps froid en se refroidissant. Ceci se produisant plus ou moins rapidement selon que l’on a des isolants ou des conducteurs thermiques.
Une expérience ou deux pièces de monnaies identiques se cognent, l’une étant immobile, montre bien le transfert du mouvement. La conservation du mouvement total est la conservation de l’énergie. Il y a transfert d’énergie du corps chaud vers le corps froid. On dit qu’il y a échange de chaleur. Le transfert s’arrête quand toutes les molécules ont la même vitesse moyenne, ce qui n’empêche pas qu’à un instant donné, certaines aillent plus vite que d’autres.
Un corps chaud contiendra d’autant plus d’énergie, que ses molécules iront vites (température élevée) et qu’il contiendra beaucoup de molécules (masse importante).
Mélangeons un volume d’eau à 300C à un volume d’eau à 200C. Le mélange est à 25 0C. Mélangeons un volume d’eau à 200C à deux volumes d’eau à 400C. Le mélange est à (20 + 40 + 40)/3 = 100/3 = 33,330C, plus près de 400C que de 200C. D’une manière générale : T = (m1 T1 + m2 T2)/(m1 + m2), m1, m2, et T1, T2 étant respectivement les masses et les températures du fluide contenu dans les deux bocaux. On peut écrire ici: 1 x (33,33 -20) = 13,33 = 2 x (40 -33,33) = 2 x 6,67. 13,33 produit de la quantité par la variation de température est la quantité de chaleur (énergie échangée).
Il ne faut donc pas confondre la température qui correspond au mouvement moyen d’une molécule et l’énergie qui correspond au mouvement total de toutes les molécules, la chaleur étant l’énergie échangée lors du contact. On peut donner une analogie avec une serviette de bain mouillée. L’humidité plus ou moins grande de la serviette mesurée localement mais uniforme, correspond à la température. La quantité totale d’eau correspond à l’énergie. Deux linges mis en contact égalisent leur degré d’humidité en échangeant la même quantité d’eau (chaleur) donnée par l’un et prise par l’autre. Le linge le plus grand verra, son humidité moins varier que celle du linge le plus petit.
Les deux bocaux communiquants de la page 6 font une bonne analogie. La surface correspond à la quantité de matière, la quantité d’eau à la quantité de chaleur échangée, et le niveau d’eau à la température. Si la surface libre n’est pas au même niveau, lors de l’établissement de l’équilibre, le petit bocal de faible surface voit son niveau varier plus que celui du grand bocal.
VII- ÉCHANGES DE CHALEUR OU TRANSFERTS DE CHALEUR
Ils peuvent avoir lieu par contact direct. Il sont appelés dans ce cas échanges par conduction; il y
a échange par choc des molécules voisines (voir VI). La chaleur se propage très rapidement dans une
barre métallique grâce aux électrons libres (qui assurent également la conduction électrique). Cet échange
se fait ainsi plus ou moins rapidement selon qu’on a un conducteur ou un isolant thermique. Métaux,
bons conducteurs, bois ou polystyrène isolant  un métal paraît froid à la main, le polystyrène paraît
chaud. Il n’est pas capable d’évacuer la chaleur de la main et se met aussitôt à 370C ce qui est
chaud.
un métal paraît froid à la main, le polystyrène paraît
chaud. Il n’est pas capable d’évacuer la chaleur de la main et se met aussitôt à 370C ce qui est
chaud.
Plus précisément : Prenons du bois et un métal dans la même pièce. Ils sont à la même température. Pourtant, au toucher, le métal paraît plus froid. Comme le métal est bien meilleur conducteur de la chaleur que la main, il évacue très rapidement le peu de chaleur que la main lui transmet, et la température de sa surface reste proche de celle de la pièce. Il en va autrement avec du bois qui, plus isolant que la main ne peut évacuer la chaleur que cette dernière lui transmet. La température de sa surface s’élève donc beaucoup dès le contact. Pour vérifier que le bois est un moins bon conducteur thermique que le métal, il suffit de poser deux glaçons identiques, l'un sur le bois, l'autre sur le métal. Le glaçon posé sur le métal fond plus vite. Le métal lui apporte plus vite la chaleur nécessaire. Idem : métal et polystyrène.
Ils peuvent avoir lieu par convection (voir VIII 4), les bulles d’air chaud (exemple : orages ou en plus petit, thermiques) ou d’eau chaude plus légères s’élevant et emportant leur chaleur.
Plus généralement, les courants de convection dus aux différences de températures en différents endroits sur la Terre sont à l’origine des vents. Les différences de températures sont causées par les différences de chauffage par le Soleil entre différents endroits. Exemple : brise de mer.
Ils peuvent avoir lieu par rayonnement (voir XIII), un corps chaud émettant un rayonnement d'autant plus intense qu'il est chaud (loi de Stephan), mais aussi de longueur d’onde d’autant plus courte qu’il est plus chaud (vibration plus rapide) : loi de WIEN (il est intuitif qu'une agitation thermique plus forte, entraînant un mouvement plus rapide des molécules donne une vibration lumineuse plus "rapide" donc de plus grande fréquence); ce rayonnement étant absorbé plus loin et transformé en chaleur. Notons qu’un corps noir absorbe mieux la lumière mais l’émet également mieux. Ainsi l'azote et l'oxygène n'absorbent pas l'infrarouge et ne peuvent donc pas l'émettre, le contraire ayant lieu pour le dioxyde de carbone.
Pour isoler des transferts de chaleur par rayonnement, il faut mettre des parois argentées qui réfléchissent le rayonnement.
Un thermomètre sensible à réservoir noirci, placé en face d’un récipient contenant de l’eau chaude, s’échauffe, parce qu’il reçoit des radiations infra-rouges, de grande longueur d’onde émises par le corps chaud.
Ils peuvent avoir lieux par chaleur latente (voir XI et XIII) (nous verrons cela plus loin). C’est le cas du cycle de l’eau où de la chaleur est transportée de bas en haut dans l’atmosphère, par évaporation de l’eau des océans et condensation en altitude de la vapeur en nuages.
Isoler thermiquement signifie diminuer le transfert de chaleur.
VIII- DILATATION DES FLUIDES, POUSSÉE D’ARCHIMÈDE
1- Dilatation des corps
Lorsque l’on chauffe un corps, l’agitation des molécules augmente. Les molécules ont alors tendance à s’écarter, ce qui fait que le volume occupé par le corps augmente. Ce phénomène a lieu aussi bien pour les solides que pour les liquides et les gaz et s’appelle la dilatation. Il est à la base de la fabrication de beaucoup de thermomètres.
a) Dilatation des solides.
Intervalles entre les rails d’un train, également, discontinuité du tablier d’un pont pour permettre la dilatation.
b) Dilatation des liquides et des gaz
Fabrication de thermomètres; possibilité de fabriquer un thermomètre avec une boîte de pellicule photo et une paille avec de la colle. Thermomètre à mercure ayant l’avantage de la rapidité (bonne conductibilité thermique du mercure) et d’aller à 1000C. Thermomètre à alcool moins cher, liquide coloré plus visible. Thermomètre à gaz : Volume proportionnel à la température absolue.
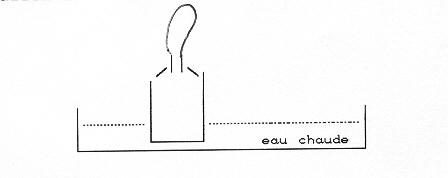
2- Poussée d’Archimède
Isolons par la pensée un volume d’eau dans l’eau. Il est soumis à son poids et il ne tombe pas. Il doit donc être soumis de la part de l’eau qui l’entoure à une force le soulevant appelée poussée d’ARCHIMÈDE. Nous verrons à propos de la pression dans un gaz, que ce sont les forces de pression qui sont à l’origine de cette poussée. On peut montrer que si le poids de liquide correspondant au volume déplacé par un corps est inférieur au poids de ce corps, ce dernier coule (et réciproquement flotte). Ainsi, si j’enfonce un ballon dans l’eau, et si je le lache ce dernier remonte à la surface. Il peut même gicler au dessus de la surface, emporté par son élan, avant de retomber.

L’objet est plus lourd que son volume d’eau, donc il coule. Dans le cas contraire, il flotterait. La poussée d'Archimède est donc égale au poids du volume de liquide déplacé.
3- Superposition de liquides
Mettons sur une balance, d’un côté un bécher rempli d’eau, de l’autre côté un bécher identique rempli exactement à la même hauteur d’huile. On voit que, à volume égaux, l’eau est plus lourde que l’huile. On dit que la densité ou la masse volumique de l’eau est plus grande que celle de l’huile. On peut alors, comme le justifie la poussée d’ARCHIMÈDE, faire flotter de l’huile sur de l’eau. On peu ainsi superposer : eau, huile, alcool, pétrole (kerdane).
4- Convection
La dilatation montre que l’eau chaude est moins dense que l’eau froide et peut flotter dessus. Au contraire, une masse d’eau chaude sous de l’eau froide montera : c’est la convection (idem avec de l’air). D’où l’expérience suivante montrant la pollution lors d’une inversion de température (analogie où l'eau remplace l'air) :


IX- CHANGEMENT D’ÉTAT SOLIDE-LIQUIDE
1- Explication moléculaire
Dans un solide, les molécules sont si près les unes des autres que tout mouvement relatif est impossible. Elles sont bloquées dans des positions fixes les unes par rapport aux autres. Lorsque la température s’élève, l’agitation permet aux molécules de s’éloigner un peu les unes des autres. Elles peuvent alors coulisser et glisser les unes par rapport aux autres en restant cependant pratiquement en contact. On obtient un liquide. C’est la fusion. Normalement un liquide occupe donc un volume plus grand que le solide. La glace fait exception. Les atomes qui s’attirent O et H s’éloignent bien, mais la structure cristalline étant détruite, les molécules peuvent davantage se rapprocher.

Les canalisations cassent donc quand l’eau gel. Il faut donc mettre de l’antigel. La glace d’autre part, flotte sur l’eau (Iceberg). Une bouteille en plastique pleine d’eau et mise, au congélateur en ressort cassée. A noter que la glace glisse : Des études récentes montrent que les molécules de la surface d'un glaçon même pour t<< 0°C sont mal attachées et glissent les unes par rapport aux autres (ceci se comprend, elles ont moins de voisines à qui s'attacher) : elles sont pratiquement à l'état "liquide". C'est pourquoi la glace glisse, même à des températures très négatives.
2- Conservation de la masse
Équilibrons une balance avec de la glace dans un récipient clos. Quand la glace a fondu, la balance est toujours équilibrée, La masse, correspondant à la quantité de matière est restée la même, ce qui est normal puisque le nombre de molécules est resté, le même.
3- Échange de chaleur lié au changement d’état
Sortons un morceau de métal et un glaçon de même taille du congélateur. Ils sont à la même température -200C. Au bout d’une demi-heure, le métal est à la température de la pièce, 200C, tandis que le glaçon est resté froid à 00C. Le glaçon refuse d’obéir à la loi de l’équilibre thermique, comme un castor dans l’eau dont la température reste constante, comme tous les animaux à sang chaud. Le castor reste chaud car il dégage de l’énergie en brulant le glucose qu’il a dans le sang. Le glaçon a donc une source de froid absorbant l’énergie (chaleur qui arrive du dehors). C’est le phénomène de fusion qui absorbe cette chaleur. Ainsi :

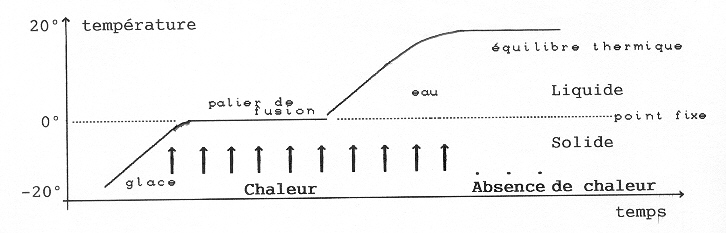
Pour l’eau, le palier se produit toujours à zéro qui est appelé point fixe. Tous les corps purs ont un point fixe qui leur est caractéristique et permet de les identifier, à moins que les molécules ne se décomposent avant qu’il soit atteint. En faisant tomber de morceaux de bougie dans de l’eau chaude, ont trouve la température à partir de laquelle ils fondent (autour de 60 degrés), température de fusion de la bougie.
De la glace ne fond pas dans une bouteille thermos, celle-ci ne permettant pas à la chaleur de pénétrer. C’est aussi pour cela qu’elle peut conserver de l’eau chaude ou de l’eau froide La bouteille thermos est un isolant thermique.
4- Autres expériences
Fabriquons un mélange de glace pilée et de sel. La température descend à -220C. Le sel fait “fondre”(dissout) la glace rapidement. Cette fusion consomme de la chaleur qui ne peut être prise qu’en abaissant la température, puisque lorsqu’un corps se refroidit, il cède de la chaleur. On voit du givre se déposer sur les parois du récipient. On peut alors faire geler de l’eau placée dans un petit tube à essai enfoncé dans ce mélange.
On peut d’ailleurs placer un thermomètre électronique dans le tube à essai. On obtient alors la courbe suivante :

On peut descendre jusquà -90C sans que l’eau ne gèle! On a de l’eau en surfusion. En A, la surfusion cesse et la température remonte par cristallisation jusqu’en B où on a un mélange d’eau et de glace. On a ensuite le palier BC correspondant à la lente cristallisation de l’eau. En C, il n’y a plus de liquide, donc plus de réserve d’énergie de disponible pour maintenir la température à O0C. La température redescend jusqu’à -220C.
La surfusion est due au fait que des morceaux de glace extrêmement petits fondent à une température inférieure à zéro.
Il est donc impossible de faire geler l'eau. Il faut commencer par de petits glaçons qui ne peuvent pas exister !
Prenons l'exemple d'un petit glaçon sphérique : les molécules à la surface sont moins bien attachées que celles
plus en profondeur, comme on l'a vu ci-dessus. Or la surface est proportionnelle à R2 et le volume
à R3, R étant le rayon du glaçon. Quand R  0, surface/volume
0, surface/volume 
 et on peut dire que toutes
les molécules sont mal attachées, d'où la plus grande difficulté pour un petit glaçon d'exister que pour un gros.
On a montré récemment que même lorsqu'il gèle très fort, la surface de la glace est recouverte d'une fine
pellicule, de quelques molécules d'épaisseur, de molécules d'eau à l'état liquide. C'est pour cela que la glace glisse. C'est ces molécules qui
entament la fusion, en particulier celle des tout petits morceaux de glace. Si on recouvre un morceau de glace de métal jointif
(peinture métallique), il peut tenir au dessus de 00C sans fondre. Si on gratte le métal, il fond et sa température descend à zéro.
Cela est analogue au refroidissement d'un mélange réfrigérant. Un choc permet de rassembler suffisamment de molécules à l'état solide en un
endroit donné, pour que ce glaçon commence à croître et à tout envahir.
et on peut dire que toutes
les molécules sont mal attachées, d'où la plus grande difficulté pour un petit glaçon d'exister que pour un gros.
On a montré récemment que même lorsqu'il gèle très fort, la surface de la glace est recouverte d'une fine
pellicule, de quelques molécules d'épaisseur, de molécules d'eau à l'état liquide. C'est pour cela que la glace glisse. C'est ces molécules qui
entament la fusion, en particulier celle des tout petits morceaux de glace. Si on recouvre un morceau de glace de métal jointif
(peinture métallique), il peut tenir au dessus de 00C sans fondre. Si on gratte le métal, il fond et sa température descend à zéro.
Cela est analogue au refroidissement d'un mélange réfrigérant. Un choc permet de rassembler suffisamment de molécules à l'état solide en un
endroit donné, pour que ce glaçon commence à croître et à tout envahir.
MALAPARTE raconte la mort dramatique d’un millier de chevaux russes dans les glaces du lac Ladoga, pendant l’hiver 1942. Pour échapper à un feu de forêt provoqué par des bombardements aériens, les chevaux se précipitent dans le lac. Malgré la vague de froid récemment arrivée, l’eau est encore liquide. Pendant que les chevaux, la tête tendue hors de l’eau, nagent vers l’autre rive, il se fait un grand bruit. L’eau gèle subitement, enfermant les bêtes dans une gangue de glace. Ce phénomène se produit si le refroidissement est rapide.
Réciproquement, prenons un sachet GIB-HOT contenant de l'acétate de sodium et cliquons le métal. Le liquide cristallise rapidement et la
température monte à 550C. Le liquide était en surfusion. Le choc fait cesser la surfusion et la
cristallisation dégage de la chaleur. L’eau également peut exister liquide en dessous de O0C. Il n’est pas rare
avec de l’eau très pure que la glace ne commence à se former que à -20C, mais dès qu’elle commence à
se former, la température se stabilise à O0C. Dans les nuages, l’eau reste liquide en surfusion jusqu’à -400C.
Un cristal de glace lancé dans l'eau fait cesser la surfusion; un choc également :
5- Explication microscopique de l’échange de chaleur
Cette échange de chaleur lié à la fusion ou à la solidification vient du fait que le liquide possède de l’énergie par le simple fait qu’il est liquide à la température donnée au lieu d'être solide. On appelle cette énergie chaleur latente. Elle vient de l’éloignement des atomes qui s’attirent par la force électrique, comme l’éloignement de la Terre d’un objet attiré par elle lui donne de l’énergie (lacs en montagne utilisés par EDF). La chaleur latente correspond donc, pour les molécules, à un gain d'énergie potentielle électrique quand on passe du solide au liquide, ou quand on passe du liquide au gaz (voir image ci-dessus sur la structure de la glace). Un objet qui tombe voit sa vitesse augmenter. De la même manière quand les atomes “tombent”les uns sur les autres quand le liquide cristallise, ils augmentent de vitesse, et cette agitation correspond à une augmentation de température.
X PROPRIÉTÉS DES GAZ
Rappelons que le fait que les molécules d’un gaz soient loin les unes des autres entraîne que les gaz sont légers, compressibles, et sont des isolants thermiques. C’est l’air emprisonné dans un pull-over qui en fait un isolant. Une fois mouillé, cette propriété disparaît.
On peut tout de même, sans parler de molécules, expliquer que puisque l’air est très léger (très peu dense), il est logique de pouvoir le comprimer (augmentation de densité) et, également que ce soit un isolant thermique (il enveloppe les corps de peu de matière, donc il y a peu de “contacts”permettant de réchauffer ou refroidir un corps.
En ce qui concerne la pression d’un gaz, elle est due au choc des molécules sur la paroi. Montrons une expérience permettant de mesurer la pression atmosphérique :

L’unité légale de force est le Newton : une masse de 1kg pèse 9,8 N . 1 Pascal = 1 N/m2. La pression moyenne à la surface de la Terre est de 1013 hectoPascals. Elle vaut également 76 cm de mercure, différence de niveau dans un baromètre à mercure, où d'un côté il y a le vide, et de l'autre, l'air (le principe des vases communiquants n'est donc plus vérifié).
C’est la gravitation, donc le poids de l’air, qui maintient cette pression au voisinage de la Terre en comprimant l’air contre le sol. La pression au dessus d’une surface de 1 cm2 est donc égale au poids de l’air situé au dessus qui correspond à une masse de 1 kg, donc à un volume de 1 m3, donc à une hauteur de 10 km. On retrouve ainsi la hauteur moyenne de la tropopause, qui marque le haut de l’atmosphère météorologique. Le poids de l’air situé au dessus diminuant avec l’altitude, la pression diminue avec l’altitude (altimètres). C’est ce phénomène qui explique la poussée d’Archimède. En effet, l’objet immergé est davantage poussé vers le haut par en bas que poussé vers le bas par en haut :

XI- CHANGEMENT D’ÉTAT LIQUIDE-GAZ
1- Évaporation
Mise en évidence : Équilibrons une balance avec de l’eau dans un des plateaux. En 1/4 d’heure, la balance se déséquilibre mettant en évidence la disparition de l’eau par évaporation. On peut mesurer le volume d’eau évaporé en une heure par exemple en rétablissant l’équilibre en versant de l’eau avec une seringue graduée. En tenant compte du rapport des surfaces et des temps, on peut avoir ainsi un ordre de grandeur de l’évaporation annuelle des océans.
Les molécules ne vont pas toutes à la même vitesse. La vitesse moyenne correspond à la température. Il y a toujours des molécules voisines de la surface et qui vont plus vite que les autres. Celles-ci se “décollent”des autres et partent libres vers le haut. Elles constituent la vapeur.
Étant donné que ce sont les plus rapides qui partent, l’eau a tendance à s’enrichir en molécules lentes. L’évaporation refroidit donc l’eau. Application, la sueur. Réciproquement, quand la vapeur d’eau se condense en eau liquide, cela dégage de la chaleur. Pour ces effets calorifiques, le raisonnement fait à propos de la fusion est encore valable.
L’évaporation a tendance à augmenter avec la température puisque les molécules plus rapides se détachent plus facilement.
S’ il y a des molécules d’eau présentes dans l’air, on dit que l’air est humide. Certaines d’entre-elles, par le fait du hasard se dirigeront vers le liquide pour y pénétrer. Leur nombre ne dépend que de la quantité de vapeur d’eau dans l’air. Par contre nous avons vu que le nombre de molécules qui partent dépend de la température. Il y a un équilibre quand autant de molécules partent et arrivent. Ceci implique que l’air chaud peut contenir beucoup plus de vapeur d’eau que l’air froid. Quand on refroidit de l’air humide, cette humidité peut donc condenser en brouillard ou nuages composés de petites gouttelettes d’eau.
Quand ceci se produit, on dit que l’air est saturé, soit 100 % d’humidité. Quand il n’y a pas de vapeur d’eau dans l’air, on dit que l’on a 0 pour cent d’humidité. Pour mesurer l’humidité de l’air, on utilise un hygromètre.
Quand l’air est sec, peu de molécules retombent dans le liquide qui s’évapore donc vite, l’évaporation n’étant pas contrariée. L’eau s’évapore donc d’autant plus vite que l’air au-dessus, est plus sec.
Psychromètre : C’est un exemple d’hygromètre. On a un thermomètre sec et un dont le réservoir est recouvert d’un coton humide. L’eau s’évaporant, ce dernier indique une température plus basse, et d’autant plus basse que l’évaporation est rapide, donc que l’air est plus sec. La différence des deux températures : TS = thermomètre sec et TM = thermomètre mouillé donne l’humidité de l’air ou degré hygrométrique (méthode utilisée dans les stations météo).
Notons que même la glace peut s’évaporer. On appelle cela, la sublimation.
On peut montrer la sublimation en chauffant légèrement des cristaux d’iode dans un ballon. Un gaz violet apparaît qui recondense en cristaux sur les parois froides.
L’évaporation est également favorisée par le vent qui enlève les molécules d’eau de la vapeur qui stagnent au dessus et risquent de retomber.
L’eau des océans qui s’évapore refroidit la surface de la Terre dont la température est ainsi abaissée de 50 degrés, rendant la vie possible. La vapeur d’eau monte ensuite par convection et se condense en nuages en altitude (voir le cycle de l’eau). Cette condensation dégage alors toute la chaleur absorbée en bas par évaporation. De la chaleur a ainsi été transportée de la surface de la Terre en haut de l’atmosphère par chaleur latente.
2- Ébullition
Quand la température s’élève suffisamment, il peut se produire des bulles de vapeur à l’intérieur du liquide. C’est l’ébullition, phénomène violent. Quand on chauffe de l’eau, il commence par se produire des petites bulles qui sont dues aux gaz dissous qui s’échappent. L’eau chaude dissout en effet moins d’oxygène, et d’azote que l’eau froide. Ensuite viennent les grosse bulles violentes qui constituent l’ébullition. L’ébullition nécessite une forte température, car il faut beaucoup de molécules d’un seul coup pour constituer une bulle, la pression ayant tendance à refermer les bulles et à les faire disparaître. Les bulles d’ébullition n’arrivent donc à se former qu’à partir d’une certaine température appelée température d’ébullition et qui dépend de la pression : 1000C pour l’eau à la pression ordinaire.
Une autre manière de dire cela, est de dire que pour qu’une bulle se forme, elle doit prendre de la place, du fait que le volume est multiplié par 1000 quand on passe du liquide au gaz. Cela force la surface libre du liquide à monter, donc à lutter contre la pression. Si la pression augmente, il faut donc une température plus élevée pour que les bulles arrivent tout de même à se former. En effet, la pression contrecarre cette montée de la surface libre du liquide, donc contrecarre la formation des bulles. Cela n’est pas nécessaire dans le cas de l’évaporation, les molécules d’eau se faufilant.
Quand la pression s’élève, les molécules dans les bulles, se rapprochent. La température d’ébullition de l’eau augmentant, l’eau liquide se dilate et les molécules du liquide s’éloignent les unes des autres. Il vient un moment où les molécules sont à la même distance moyenne les unes des autres dans le liquide et dans le gaz. Il n’y a plus de distinction possible entre le liquide et le gaz. On a atteint le point critique.
Comme la pression diminue avec l’altitude, la température d’ébullition de l’eau également, régulièrement de 10C tous les 300 m. L’eau bout donc à 990C en haut de la tour Eiffel et à 840C en haut du Mont Blanc.

Le chiffon mouillé refroidit le tube à essai. La vapeur d’eau condense sur les parois en gouttelettes liquides, faisant baisser la pression. L’eau se remet alors à bouillir à une température inférieure à 1000C.
Si on baisse suffisamment la pression, l’eau peut même bouillir à 00C. L’eau liquide ne peut alors plus exister, car elle se met à bouillir dès qu’elle se forme. Seuls les états solides et gazeux peuvent exister. Ainsi, l’existence de l’état liquide nécessite une pression suffisante pour exister. Pour cette raison, l’eau liquide n’existe pas sur la Lune, ni sur Mars.
L’ébullition de l’eau, passage de l’état liquide à l’état vapeur correpond à un éloignement des molécules qui s’attirent et nécessite donc de l’énergie (les molécules qui s’attirent pendant qu’elles s’éloignent ralentissent). Cette énergie est habituellement apportée sous forme de chaleur.

Quand on est à 1000C, toute la chaleur est utilisée pour faire bouillir l’eau et il n’y en a pas de disponible pour élever la température. Par conséquent, tant qu’il reste de l’eau à bouillir, la température reste à 1000C.
XII- COMPLÉMENTS
1- Rosée, buée, givre, brouillard, nuage
Rappelons le bilan de tous les changements d’états possibles :
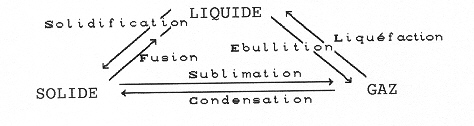
La rosée comme la buée sont dues à la liquéfaction de la vapeur d’eau en gouttelettes d’eau liquide sur une paroi froide. Pour la rosée, il s’agit du sol. Pour faire de la buée, il suffit de verser de l’eau très froide dans un verre.
Le givre est la condensation de vapeur d’eau en glace. Il suffit de sortir un objet du congélateur. Il se couvre de givre. On obtient également du givre sur les parois du récipient lors de l’expérience du mélange réfrigérant sel-glace pilée.
Le brouillard, comme le nuage, est constitué non de vapeur d’eau, mais de gouttelettes d’eau liquide de 1 à 10 microns. Seuls les cirrus sont constitués de cristaux de glace (t < -400C). Pour montrer le phénomène, il suffit d’observer le nuage au dessus d’une casserole d’eau bouillante. En toute rigueur, il ne s’agit pas de fumée, car la fumée est constituée de petites particules solides. Dans le cas où il n’y a pas de brouillard au dessus de la casserole, une petite coupelle placée au dessus recueille toujours des gouttelettes d’eau. Cette liquéfaction, montre la conservation de l’eau lors de l’évaporation (l’eau ne disparaît pas). Un peu d’eau tiède au fond d’un bécher profond aux parois également tièdes vient se condenser sur une plaque de verre posée sur l’ouverture alors que l’on n’a rien vu passer, ce qui prouve que la vapeur d’eau est invisible.
2- Différence fusion dissolution
Un solide comme le sucre disparaît dans l’eau. Une balance permet de vérifier que le corps est encore présent dans l’eau. Il ne s’agit pas de fusion mais de dissolution. C’est l’eau qui dissout le sucre, c’est la chaleur qui fait fondre le glaçon. Un glaçon enfermé dans un sac plastique étanche plongé dans l’eau fond, tandis que dans les mêmes conditions, un sucre reste intact. Réfléchir à ce sujet sur la disparition d’un glaçon dans de l’eau légèrement salée à -0,000000010C. Est-ce de la fusion ou de la dissolution? idem à +0,000000010C et sans sel.
Les gaz également se dissolvent dans l’eau. Un corps dissous dans l’eau peut être considéré du point de vue moléculaire à l’état liquide (voir question ci-dessus). C’est pourquoi une élévation de température augmente la solubilité des solides et diminue celle des gaz.
On peut aussi envisager la “dissolution”d’un liquide dans un autre liquide. Quand elle se fait en toutes proportions, on dit que les deux liquides sont miscibles. Exemple, eau et alcool, Si il y a saturation, les deux liquides se séparent. Exemple, eau et huile. Ainsi, lorsque de l’huile flotte sur l’eau, il y a un peu de molécules d’huile dissoutes dans l’eau, et cette solution d’huile est saturée. Le reste de l’huile ne se dissout pas, et flotte sur l’eau. Idem en permutant huile et eau.
A noter également que la “fusion”de la glace causée par le sel, sans élévation de température, ne peut en fait être une fusion; c’est une dissolution dans le liquide mélange d’eau et de sel (voir question ci-dessus). On voit que du point de vue moléculaire, la distinction présente peu d’intérêt.
XIII- LE CYCLE DE L’EAU
Le cycle de l’eau fonctionne parce qu’il fait toujours chaud en bas, ceci permettant à l’eau des océans de s’évaporer, et froid en haut, ceci permettant à la vapeur d’eau montée par convection de se condenser en eau liquide qui précipite. La Terre est donc en déséquilibre thermodynamique permanent. Ce sont le Soleil et les propriétés de transparence de l’atmosphère aux différents rayonnement qui crèent ce phénomène.
Le Soleil émet de la lumière visible : température 5780 K, lambda = 0,5 microns . Un calcul montre que la Terre qui reçoit cette énergie devrait, pour maintenir sa température constante émettre vers l’espace de l’infrarouge : lambda = 11,33 micron . Cela correspond avec la loi de WIEN à une température de : T = 5780 x 0,5/11,33 = 255 K soit -180C, température de 330C plus basse que la température moyenne de la surface de la Terre qui est de 150C. D’où vient ce réchauffement?
L’atmosphère est transparente à la lumière visible et opaque à l’infrarouge. La lumière solaire atteint donc le sol qu’elle chauffe, tandis que le rayonnement émis par la surface terrestre est piégé. C’est l’effet de serre augmentant la température de la surface terrestre. En conclusion, la lumière du Soleil arrive jusqu’au sol et chauffe ce dernier. Seule la haute atmosphère est capable d’évacuer cette chaleur vers l’espace en rayonnant en infrarouge. L’atmosphère est donc chauffée par en bas et refroidie par en haut. La chaleur monte de bas en haut par rayonnement, convection, et chaleur latente.
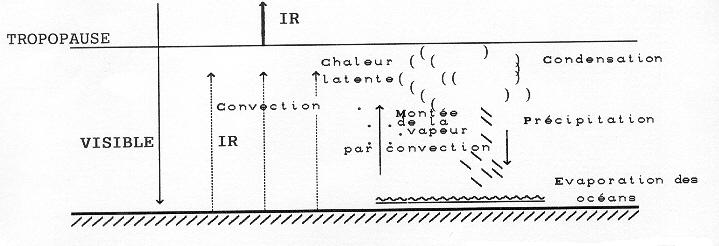
Indépendamment de son utilité pour donner de l’énergie (barrages EDF) et de l’eau pure sur les continents, le cycle de l’eau est indispensable pour maintenir une température convenable à la surface de la Terre grâce au refroidissement des océans par évaporation. Nous avons vu en effet au XI 1 que l’effet de serre entraînerait une température moyenne de 50 + 15 = 650C au sol, sans cet effet de refroidissement.
Expérience : Deux thermomètres l’un recouvert d’une feuille noire, l’autre d’une feuille blanche. Le noir symbolise la surface terrestre opaque, le blanc l’atmosphère transparente. Eclairés au Soleil ou par un projecteur de diapositives, le thermomètre noir chauffe plus vite parce qu’il absorbe davantage la lumière. Réciproquement si ils sont tous les deux chauds, le noir refroidit plus vite, émettant plus d’infrarouge. C’est parce que l’atmosphère est opaque à l’infrarouge, qu’elle est capable d’en émettre.
Expérience de précipitation : On sature de l’eau avec du sel, puis on y verse de l’alcool à 900. Le sel moins soluble dans le mélange eau alcool précipite. On simule ainsi une précipitation de pluie ou de neige.
Ainsi, la température agréable de la surface terrestre est le résultat d’un équilibre judicieux entre le réchauffement par l’effet de serre, et le refroidissement par l’évaporation.