V- Loi d'Avogadro
1) Pression d'un gaz
Dans l'animation ci-contre
(treizième animation), on voit que lorsqu'une molécule frappe le piston, elle rebondit
sur ce dernier, mais a tendance à le repousser. Cette force appliquée
qui en fait est proportionnelle à la fréquence des chocs et à la vitesse perpendiculairement à la paroi,
est proportionnelle également à la surface, pour un gaz constitué
d'un grand nombre de molécules et donne la pression du gaz : P = F/S ; la force F étant mesurée en Newton (N)
(environ le poids d'une masse de 100 g), et la surface en m2, la pression P est mesurée en Pascal
(Pa).
La pression atmosphérique moyenne est de 1013 hectopascal. Si elle est supérieure, on est dans un anticyclone, si elle
est inférieure dans une dépression. Si on augmente la vitesse d'une molécule, ce qui correspond à
une augmentation de température, elle repousse le piston plus fort.
La pression augmente donc avec la température. Le piston oscille à cause de son inertie, mais un léger frottement fini par
le
stabiliser.
2) Compressibilité et résistance à la compression des gaz.
On voit que si on augmente la pression d'un côté du piston, le volume de l'autre côté diminue. On
peut donc diminuer
le volume d'un gaz. Ceci est possible parce que les molécules sont éloignées les unes des autres et peuvent être
rapprochées. Dans un liquide où les molécules sont en contact, c'est impossible, et un liquide est incompressible.
Cependant, à température constante, donc à vitesse de la molécule constante, plus le volume disponible est
petit,
plus la molécule fait des allers et retours rapidement, donc plus la pression est forte. On peut même dire,
que la fréquence des chocs, donc la pression, est inversement proportionnelle au volume. Le gaz résiste donc
à une diminution de volume imposée.
3) Loi d'Avogadro
Avogadro est
un chimiste italien. Il formula la loi
selon laquelle le nombre de molécules contenu dans deux volumes égaux de gaz à même température et même pression
est identique. Un gaz est donc moins dense simplement si ses molécules pèsent moins lourd.
Mais un gaz moins dense qu'un autre s'élève au dessus de ce dernier
par l'effet de la poussée d'Archimède.
La molécule d'eau
étant très légère, l'air humide est moins dense. C'est ce qui explique pourquoi les alizés
qui se chargent progressivement
d'humidité en circulant sur les océans finissent par s'élever au niveau de la Z.C.I.T. (zone de convergence intertropicale).
Cela explique aussi l'hystérésis du climat, un beau temps sec donnant de l'air lourd donc favorisant la présence
d'un anticyclone, donc du beau temps.
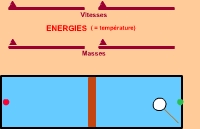
On peut formuler la loi en disant : deux gaz contenant le même nombre de molécules (dans l'animation une)
et à la même température, auront la même pression quand ils occuperont des volumes égaux. C'est ce qui explique
pourquoi le piston se stabilise au milieu (pression égale des deux côtés) quand l'énergie des deux molécules est
la même (même température).
L'explication de cette loi est simple :
pour deux volumes identiques, la pression est proportionnelle au nombre de molécules; à la force appliquée lors
du choc, qui est proportionnelle à la masse et à la vitesse; et à la fréquence des impacts elle même
proportionnelle à la vitesse. Cette double proportionnalité à la vitesse, donne une proportionnalité à V2.
Finalement P  N m V2
N m V2  N T . La pression sera donc la même si
N le nombre de
molécule est le même, indépendamment de la nature du gaz, et si T la température est la même.
N T . La pression sera donc la même si
N le nombre de
molécule est le même, indépendamment de la nature du gaz, et si T la température est la même.
Dans l'animation, on peut choisir une vitesse quelconque et une masse quelconque pour les particules. Si l'énergie,
donc la température est la même, la pression sera la même quand les volumes seront égaux. Donc le piston se
stabilisera au milieu.