II- Explication des changements d'états
1) Animation avec deux molécules
Nous voilà maintenant avec des molécules (qui peuvent se réduire à un atome), qui peuvent
être considérées comme des sphères dures impénétrables (répulsion violente à très courte distance produisant des chocs entre les molécules),
qui s'attirent quand elles sont proches les unes des autres, et sont sans action entre-elles quand elles sont à une distance
grande devant leur rayon (attraction de
Van der Waals en 1/r
7). Ces molécules sont animées d'une vitesse qui
augmente avec la température (la température est proportionnelle à la moyenne du carré de la vitesse). Réalisons cela avec une animation
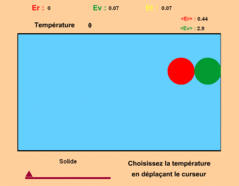
où il y a deux billes enfermées dans une boîte
(animation ci-contre à droite).
Lorsqu'une bille en cogne une autre, le choc est élastique. Lorsqu'une bille cogne une paroi, la vitesse parallèle à la paroi est conservée,
et elle repart perpendiculairement à la paroi avec une vitesse prise ici proportionnelle à la température.
Quand deux billes sont à une distance supérieure à 50 pixels ou inférieure à 10 pixels, elles sont sans interaction.
Pour une distance comprise entre 10 et 50 pixels, elles s'attirent comme avec un élastique (force proportionnelle à la distance).
Une force supplémentaire fait que la partie droite de la bille rouge attire la partie gauche de la bille verte; cette force supplémentaire
est ajoutée pour pouvoir créé ici l'état solide.
Cela traduit le fait
que souvent, la force entre deux molécules dépend de leur position relative, et pas uniquement de leur distance.
2) Analyse des changements d'états dans l'animation
À haute température, les molécules vont tellement vite que leur interaction est négligeable. En dehors des chocs, elles circulent
librement. On a un gaz. À plus basse température, les molécules peuvent rester reliées : on a un liquide. Le choc
entre deux molécules étant élastique, pour que deux molécules séparées puissent se lier, le choc doit
avoir lieu près d'une paroi, la paroi absorbant le surplus d'énergie. On peut donc avoir un retard à la liquéfaction de la vapeur (le mot vapeur
caractérise l'état gazeux quand on travaille sur les changements d'états). On dit que la vapeur est sursaturée. Dans le cas du retard du passage
de l'état liquide à l'état solide, on dit que le liquide est en surfusion. Ce retard est également observable ici, l'état solide étant caractérisé
par une position relative fixe des deux billes, la bille rouge étant à gauche de la verte.
Si, quand on abaisse la température, la bille rouge est à droite,
cela peut prendre un certain temps pour qu'elle passe à gauche.
La surfusion de l'eau est à l'origine du verglas. Par contre, le démarrage de la
fusion est instantané pour l'eau, car la glace est toujours
recouverte d'un film d'eau liquide à la surface, même à une température très négative. C'est la raison pour
laquelle la glace et la neige glissent. Il peut y avoir par contre un retard à l'ébullition.
Il ne faut jamais par exemple essayer de
faire bouillir de l'eau dans un four à micro-ondes, elle peut exploser à la figure quand on la sort du four.
D'une manière générale, il est toujours dangereux de faire chauffer de l'eau au four à micro-ondes, comme dans un bol par exemple,
pour se faire du thé, car si par mégarde, on laisse chauffer l'eau trop longtemps (plus de 3 mn par exemple), sa température est au dessus de 100°C,
et lorsque l'on verse le sachet de thé, elle gicle à la figure provoquant des brûlures au visage au deuxième degré.
Exercice : trouver les températures de fusion et de vaporisation dans l'animation
(
cliquer ici pour la solution).
Suite : quelques confirmations.