


IX- CHANGEMENT D’ÉTAT SOLIDE-LIQUIDE
1- Explication moléculaire
Dans un solide, les molécules sont si près les unes des autres que tout mouvement relatif est impossible. Elles sont bloquées dans des positions fixes les unes par rapport aux autres. Lorsque la température s’élève, l’agitation permet aux molécules de s’éloigner un peu les unes des autres. Elles peuvent alors coulisser et glisser les unes par rapport aux autres en restant cependant pratiquement en contact. On obtient un liquide. C’est la fusion. Normalement un liquide occupe donc un volume plus grand que le solide. La glace fait exception. Les atomes qui s’attirent O et H s’éloignent bien, mais la structure cristalline étant détruite, les molécules peuvent davantage se rapprocher.
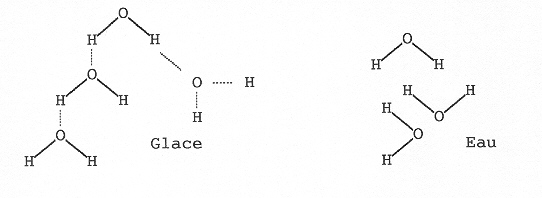
Les canalisations cassent donc quand l’eau gel. Il faut donc mettre de l’antigel. La glace d’autre part, flotte sur l’eau (Iceberg). Une bouteille en plastique pleine d’eau et mise, au congélateur en ressort cassée. A noter que la glace glisse : Des études récentes montrent que les molécules de la surface d'un glaçon même pour t<< 0°C sont mal attachées et glissent les unes par rapport aux autres (ceci se comprend, elles ont moins de voisines à qui s'attacher) : elles sont pratiquement à l'état "liquide". C'est pourquoi la glace glisse, même à des températures très négatives.
2- Conservation de la masse
Équilibrons une balance avec de la glace dans un récipient clos. Quand la glace a fondu, la balance est toujours équilibrée, La masse, correspondant à la quantité de matière est restée la même, ce qui est normal puisque le nombre de molécules est resté, le même.
3- Échange de chaleur lié au changement d’état
Sortons un morceau de métal et un glaçon de même taille du congélateur. Ils sont à la même température -200C. Au bout d’une demi-heure, le métal est à la température de la pièce, 200C, tandis que le glaçon est resté froid à 00C. Le glaçon refuse d’obéir à la loi de l’équilibre thermique, comme un castor dans l’eau dont la température reste constante, comme tous les animaux à sang chaud. Le castor reste chaud car il dégage de l’énergie en brulant le glucose qu’il a dans le sang. Le glaçon a donc une source de froid absorbant l’énergie (chaleur qui arrive du dehors). C’est le phénomène de fusion qui absorbe cette chaleur. Ainsi :

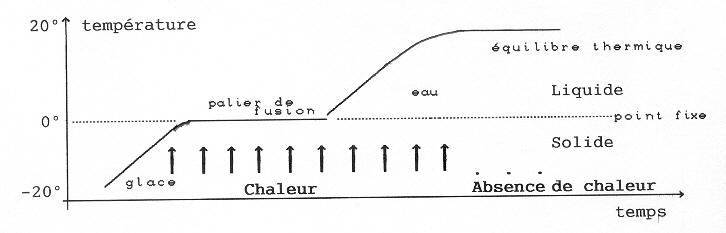
Pour l’eau, le palier se produit toujours à zéro qui est appelé point fixe. Tous les corps purs ont un point fixe qui leur est caractéristique et permet de les identifier, à moins que les molécules ne se décomposent avant qu’il soit atteint. En faisant tomber de morceaux de bougie dans de l’eau chaude, ont trouve la température à partir de laquelle ils fondent (autour de 60 degrés), température de fusion de la bougie.

De la glace ne fond pas dans une bouteille thermos, celle-ci ne permettant pas à la chaleur de pénétrer. C’est aussi pour cela qu’elle peut conserver de l’eau chaude ou de l’eau froide La bouteille thermos est un isolant thermique.
4- Autres expériences
Fabriquons un mélange de glace pilée et de sel. La température descend à -220C. Le sel fait “fondre”(dissout) la glace rapidement. Cette fusion consomme de la chaleur qui ne peut être prise qu’en abaissant la température, puisque lorsqu’un corps se refroidit, il cède de la chaleur. On voit du givre se déposer sur les parois du récipient. On peut alors faire geler de l’eau placée dans un petit tube à essai enfoncé dans ce mélange.
On peut d’ailleurs placer un thermomètre électronique dans le tube à essai. On obtient alors la courbe suivante :
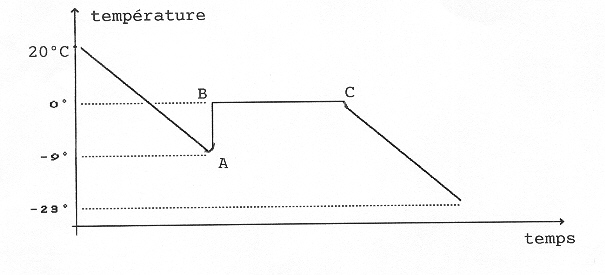
On peut descendre jusquà -90C sans que l’eau ne gèle! On a de l’eau en surfusion. En A, la surfusion cesse et la température remonte par cristallisation jusqu’en B où on a un mélange d’eau et de glace. On a ensuite le palier BC correspondant à la lente cristallisation de l’eau. En C, il n’y a plus de liquide, donc plus de réserve d’énergie de disponible pour maintenir la température à O0C. La température redescend jusqu’à -220C.
La surfusion est due au fait que dès
que l’on est en dessous de O0C des cristaux se forment, mais ils sont petits et plus
fragiles que les gros. Par conséquent ils peuvent être
détruits par l’agitation thermique en dessous de O0C, alors que les
gros résistent jusqu’à O0C.
Prenons l'exemple d'un petit glaçon sphérique : les molécules à la surface sont moins bien attachées que celles
plus en profondeur, comme on l'a vu ci-dessus. Or la surface est proportionnelle à R2 et le volume
à R3, R étant le rayon du glaçon. Quand R  0, surface/volume
0, surface/volume 
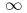 et on peut dire que toutes
les molécules sont mal attachées, d'où la plus grande difficulté pour un petit glaçon d'exister que pour un gros.
et on peut dire que toutes
les molécules sont mal attachées, d'où la plus grande difficulté pour un petit glaçon d'exister que pour un gros.
MALAPARTE raconte la mort dramatique d’un millier de chevaux russes dans les glaces du lac Ladoga, pendant l’hiver 1942. Pour échapper à un feu de forêt provoqué par des bombardements aériens, les chevaux se précipitent dans le lac. Malgré la vague de froid récemment arrivée, l’eau est encore liquide. Pendant que les chevaux, la tête tendue hors de l’eau, nagent vers l’autre rive, il se fait un grand bruit. L’eau gèle subitement, enfermant les bêtes dans une gangue de glace. Ce phénomène se produit si le refroidissement est rapide.
Réciproquement, prenons un sachet GIB-HOT contenant de l'acétate de sodium et cliquons le métal. Le liquide cristallise rapidement et la
température monte à 550C. Le liquide était en surfusion. Le choc fait cesser la surfusion et la
cristallisation dégage de la chaleur. L’eau également peut exister liquide en dessous de O0C. Il n’est pas rare
avec de l’eau très pure que la glace ne commence à se former que à -20C, mais dès qu’elle commence à
se former, la température se stabilise à O0C. Dans les nuages, l’eau reste liquide en surfusion jusqu’à -400C.
Un cristal de glace lancé dans l'eau fait cesser la surfusion; un choc également :
5- Explication microscopique de l’échange de chaleur
Cette échange de chaleur lié à la fusion ou à la solidification vient du fait que le liquide possède de l’énergie par le simple fait qu’il est liquide à la température donnée au lieu d'être solide. On appelle cette énergie chaleur latente. Elle vient de l’éloignement des atomes qui s’attirent, comme l’éloignement de la Terre d’un objet attiré par elle lui donne de l’énergie (lacs en montagne utilisés par EDF). Un objet qui