R1- Fusion : passage de l'état solide à l'état liquide sous l'action de la chaleur.
Dissolution : mise en contact d'une substance solide, liquide ou gazeuse,
appelée soluté, avec un liquide (solvant), pour obtenir un mélange liquide homogène (ou solution).
Le sel se dissout dans l'eau.
R2- Solide (glace ou neige), liquide et gazeux (vapeur d'eau).
S donne L : fusion; S donne V : sublimation; L donne V : vaporisation (évaporation ou ébullition); V donne L : liquéfaction;
V donne S : condensation; L donne S : solidification.
On passe du solide au liquide, puis du liquide au gaz en chauffant. Cependant, la sublimation et l'évaporation se produisent
à toutes températures, à condition que la pression de vapeur soit suffisamment faible, et qu'on ne soit pas à une trop basse température.
La fusion se produit à 0°C. L'ébullition se produit à 100°C sous la pression atmosphérique moyenne (1013 hPa ).
R3- Fumée : petites particules solides en suspension dans l'air; exemple, fumée obtenue par la
cristallisation de la vapeur d'eau présente dans l'air, en présence d'azote liquide.
Vapeur : gaz; exemple, vapeur d'eau.
Brouillard : petite gouttelettes liquides microscopiques en suspension dans l'air; exemple, brouillard en météorologie, la nuit, lors de la
liquéfaction de la vapeur d'eau à cause du refroidissement nocturne.
R4- La vapeur d'eau présente dans la pièce se liquéfie sur les parois froides de la bouteille, en une multitude de petites
gouttelettes d'eau liquide qu'on appelle la buée.
R5- Même réponse que précédemment, mais ensuite, le verre se réchauffe, et la buée finit par sévaporer.
R6- a) La glace disparaît, tandis que de l'eau apparaît. D'autre part, la température reste constante à 0°C (palier).
On peut mesurer que la masse totale reste constante
(conservation de la matière) tandis que le volume diminue. On peut mesurer également la quantité d'énergie nécessaire pour faire fondre 1kg de glace.
b) La température n'est pas constante (on n'a plus un corps pur), et elle est inférieure à 0°C. La masse se conserve encore et le volume diminue encore.
R7- La température d'ébullition de l'eau est plus élevée, car la pression est plus élevée et la température d'ébullition de
l'eau dépend de la pression. L'agitation thermique est plus forte, et les protéines des aliments se dégradent plus vite par les chocs
plus violents avec les voisines.
À la sortie de la soupape, sur quelques milimètres, on ne voit rien, car la vapeur d'eau qui sort est invisible. Puis, on voit
du brouillard, résultat de la liquéfaction de la vapeur d'eau qui se refroidit en se mélangeant à l'air ambiant.
R8- La température s'élève progressivement puis, à la neuvième minute, au moment où l'eau se met à bouillir, reste constante.
C'est le palier d'ébullition.
La température s'élève, car l'eau reçoit de la chaleur. Mais, quand l'eau bout, la température reste constante; c'est le cas pour tous les corps purs. Toute la chaleur apportée
à l'eau est alors consommée par le changement d'état liquide-gaz (échange d'énergie lié aux changements d'états).
Si on chauffe plus fort, la température restera encore voisine de 100°C, mais l'ébullition sera plus violente.
On n'a pas tout à fait 100°C, soit à cause d'une légère erreur du thermomètre, mais aussi plus simplement, parce que le palier à 100°C
correspond à l'état d'équilibre thermodynamique idéal entre un liquide et sa vapeur qui n'est jamais atteint. D'autre part, la surpression des bulles de vapeur due
à une profondeur de 4 cm donne une ébullition à 100,1°C. Idem, une pression de 763 mm de mercure due à une situation météorologique anticyclonique.
Une pression de 780 mm de mercure dans un anticyclone
donne une température d'ébullition de 101°, et pour une dépression de 740 mm de mercure, on a 99°.
R9- Les gaz sont environ 1000 fois moins denses que les liquides. Quand un liquide se transforme en gaz par ébullition,
le volume est donc multiplié par 1000, c'est ce volume de gaz sous pression qui actionne la machine à vapeur.
R10- La glace ne peut pas exister à une température positive. En effet, même à une température très négative, il y a un
film d'eau liquide à la surface de la glace (molécules de la surface moins bien attachées). C'est pour cette raison que la glace et la neige glissent; ce film joue le rôle de lubrifiant.
Dès que l'on dépasse
0°C, la fusion commence à partir de ce film d'eau liquide à la surface, et pénètre dans le solide.
R11- L'eau liquide peut exister à une température négative, c'est la surfusion. Le phénomène de surfusion est à l'origine du
verglas : il pleut de l'eau liquide à une température négative qui gèle au contact du sol.
R12- La température d'ébullition de l'eau varie avec la pression (variation de la pression de vapeur saturante avec la
température), or la pression varie avec l'altitude.
R13- La température reste de 100°C (à 1013 hPa ), mais l'ébullition est plus violente.
R14- La vapeur d'eau invisible condense en gouttelettes d'eau liquide qui forment le brouillard,
par refroidissement, quand il fait froid.
R15- La glace flotte dans l'eau parce qu'elle est moins dense que l'eau. Ceci, parce que l'eau augmente de volume
quand elle gèle, ce qui peut faire exploser une tuyauterie.
R16- La température de congélation de l'eau salée est inférieure à celle de l'eau douce. Le sel se dissout dans le film d'eau
liquide toujours présent à la surface de la glace. La glace au contact de cette eau salée n'est pas en équilibre, elle le serait à une température
plus basse; donc elle fond. La fusion de cette glace absorbe de l'énergie, ce qui refroidit le milieu
(l'énergie est prise à l'énergie d'agitation thermique).
R17- Dans le ballon, il n'y a que de la vapeur d'eau et de l'eau liquide. Cette vapeur d'eau condense, et la baisse de pression
fait que l'eau rentre par le tube refroidissant encore plus la vapeur d'eau. Le ballon se remplit totalement d'eau très rapidement.
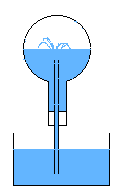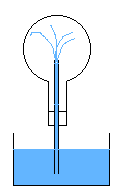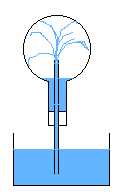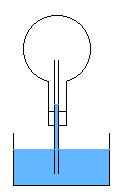 La dilatation différentielle du ballon due à des zone froides proches des zones chaudes peut toutefois le fissurer, et avec le vide qui se crée,
il peut imploser. Il est donc conseillé de plonger le tube dans de l'eau proche de l'ébullition, de façon à éviter un tel choc thermique.
La dilatation différentielle du ballon due à des zone froides proches des zones chaudes peut toutefois le fissurer, et avec le vide qui se crée,
il peut imploser. Il est donc conseillé de plonger le tube dans de l'eau proche de l'ébullition, de façon à éviter un tel choc thermique.
R18- Non, le volume diminue, à cause de la rupture des liaisons hydrogènes, liaisons qui donnent une structure très lacunaire à la glace.
R19- La masse se conserve par conservation de la matière (conservation du nombre de molécules).
Pour le vérifier, il faut boucher le récipient (pour éviter que de la buée ne vienne se déposer à l'intérieur), et essuyer le récipient (pour enlever
la buée qui se dépose à l'extérieur).
R20- Les cristaux de sel ne contiennent pas d'eau. La glace ne contient pas de sel. Le film d'eau liquide
à la surface de la glace est
saturé de sel. La fusion commence à la température de congélation de l'eau saturée de sel, soit : - 21,6°. Si le sel est en excès, la solution
est toujours saturée de sel, et pendant toute la durée de fusion de la glace, la température est de - 21,6°. La glace n'est pas salée. Au fur et
à mesure qu'elle fond, elle apporte de l'eau douce. Si la glace est en excès, au bout d'un certain temps, la solution cesse d'être saturée en sel,
tout le sel s'est dissous, et la salinité continue de diminuer par l'apport
de l'eau douce venant de la glace. La température monte alors progressivement,
car moins la solution est salée, plus la température de congélation est élevée.
Quand toute la glace est fondue, ce qui se produit à une température négative, la température monte plus franchement, car il n'y a plus absorption
d'énergie par la fusion. En conclusion, si la glace est en excès, il n'y a plus de palier.
R21- Si l'on a de l'air très sec à 10°, en même temps que la vapeur se refroidit, elle se mélange à de l'air très sec.
La condensation en brouillard ne se produit pas. Si l'air est très humide, c'est le refroidissement qui l'emporte sur la dilution de la vapeur, et
le brouillard se forme.

 La dilatation différentielle du ballon due à des zone froides proches des zones chaudes peut toutefois le fissurer, et avec le vide qui se crée,
il peut imploser. Il est donc conseillé de plonger le tube dans de l'eau proche de l'ébullition, de façon à éviter un tel choc thermique.
La dilatation différentielle du ballon due à des zone froides proches des zones chaudes peut toutefois le fissurer, et avec le vide qui se crée,
il peut imploser. Il est donc conseillé de plonger le tube dans de l'eau proche de l'ébullition, de façon à éviter un tel choc thermique.