I- Les atomes
1) Apparition de la théorie atomique
La théorie atomique est apparue chez les grecs avec
Démocrite et
Épicure. Leurs pensées furent
soutenues par le poète et philosophe romain
Lucrèce (environ 98-55 avant J.C.) dans son ouvrage
De Rerum Natura :
Livre deuxième/72-100
"
Si tu (le
tu fait référence à Aristote auquel le philosophe s'oppose)
penses que les atomes, principes des choses, peuvent trouver le
repos et dans ce repos engendrer toujours de nouveaux mouvements, tu te trompes et t'égares loin de la vérité. Puisqu'ils errent dans le vide, il faut
qu'ils soient tous emportés, soit par leur pesanteur propre, soit par le choc d'un autre corps. Car s'il leur arrive dans leur agitation de se rencontrer
avec choc, aussitôt ils rebondissent en sens opposés : ce qui n'a rien d'étonnant puisqu'ils sont corps très durs, pesants, denses, et que rien
derrière eux ne les arrête."
Livre deuxième/111-150
"
Une autre raison d'observer attentivement les corpuscules qui s'agitent en désordre dans un rayon de Soleil, c'est qu'une telle agitation nous révèle
les mouvements invisibles auxquels sont entraînés les éléments de la matière. car souvent tu verras beaucoup de ces poussières, sous
l'impulsion sans doute de chocs imperceptibles, changer de direction, rebrousser chemin, tantôt à droite, tantôt
à gauche et dans tous les sens. Or, leur mobilité tient évidemment à celle de leurs principes."
Dans le procès fait par l'église à
Galilée, il semble que la charge la plus grave qui lui fut reprochée soit la défense de la théorie atomique,
qui semblait, pour l'église, en contradiction avec l'eucharistie et la transsubstantation : comment du pain, fait d'atomes de pain, peut-il se transformer
en une autre substance?
La théorie atomique, fut soutenue par Newton
(Principia mathematica 1687) :
"
Il me paraît très probable que Dieu forma au commencement la matière de particules solides, pesantes, dures, impénétrables, mobiles."
Citons enfin Feynman, (1918-1988) prix Nobel de physique 1965 :
"Si toute la connaissance scientifique disparaissait dans un cataclysme, quelle phrase
unique pourrait préserver le maximum d’information pour les générations futures?
Comment pourrions-nous leur transmettre au mieux notre compréhension du monde?
Je propose : « Toutes choses sont faites d’atomes, petites particules animées
d’un mouvement incessant, qui s'attirent lorsqu’elle sont distantes les unes des
autres, mais se repoussent lorsqu’on les force à se serrer trop près. » Cette seule
phrase contient, vous le verrez, une quantité énorme d’information sur
le monde, pour peu que l’on y mette un peu d’imagination et de réflexion."
2) L'agitation thermique
L'agitation perpétuelle des atomes mentionnée par
Lucrèce est reliée à la température.
Plus l'objet est chaud, plus les atomes sont agités, et la température, au niveau des molécules,
est cette agitation.
Ce qui fait que lorsque les atomes ne bougent plus, on a atteint le froid absolu de -273°C.
Le lien entre agitation des atomes et température (d'où le nom d'agitation thermique) fut découvert par le biologiste
Robert Brown
(botaniste britannique) en 1827 :
la vidéo ci-contre à droite montre de petites sphères de polystyrène de diamètres 1 micron plongées dans de l'eau. Elles sont
vues avec
un microscope, animées d’un mouvement désordonné incessant à cause de leurs chocs avec les molécules.
Lors de l'expérience originale, il s'agissait de
pollen de Clarkia pulchella (une espèce de fleur sauvage nord-américaine).
Il est difficile de s'imaginer un tel mouvement
perpétuel
au niveau des molécules, alors que dans la vie courante, tout objet animé finit par s'arrêter par frottement. Mais
en fait, le mouvement de l'objet macroscopique est donné au molécules, et le corps s'échauffe. Le mouvement total se conserve, ce qui correspond
à la conservation de l'énergie. Les molécules évoluent dans le vide, comme les objets astronomiques, et les mouvements astronomiques ne s'arrêtent jamais.
3) Exemple : structure de la glace
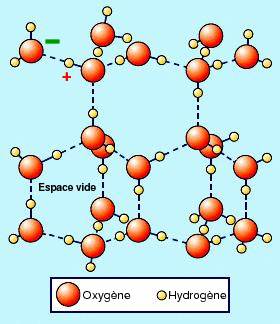
La mécanique quantique explique pourquoi, dans la molécule d'eau, à cause de la structure électronique des atomes, l'atome d'oxygène,
attire plus les électrons que l'atome d'hydrogène. Dans la molécule d'eau, il y a donc des charges électrostatiques positives sur les
atomes d'hydrogène, et une charge négative sur l'oxygène, la molécule étant globalement neutre. Les molécules s'attirent alors par des forces
électrostatiques, et peuvent former un solide, la glace. On voit cependant sur
la photographie à droite, que les molécules se disposent de façon à réaliser un solide très
lacunaire (plein de vides). La glace occupe donc un volume plus grand que la même quantité d'eau liquide. La glace est donc moins dense que l'eau et
flotte sur l'eau. Peu de corps ont cette propriété. La plupart des substances se contractent quand elles passent du liquide au solide. Si l'eau
n'avait pas cette propriété, la vie ne pourrait pas exister sur la Terre, car les glaciers qui se jettent dans les océans couleraient au fond
de ces derniers là
où la glace serait
bien isolée thermiquement.
Les océans se rempliraient progressivement de glace et deviendraient blanc. Ils ne pourraient plus alors absorber le rayonnement solaire, et la Terre
tout entière gèlerait. Une forte pression qui tend à diminuer le volume a donc tendance à liquéfier la glace (notons que ce n'est pas ce phénomène qui
est en cause dans le fait que la glace glisse). Mais, il semble que ce phénomène soit la raison de la persistance de l'état fluide de l'eau
dans de petits espaces confinés comme les cellules biologiques. Voilà une deuxième utilité pour l'existence de la vie de ce phénomène.
Ce phénomène est par contre responsable de la rupture des canalisations quand l'eau gèle dedans.
Il y a souvent une confusion entre ces espaces vides entre les molécules dans la glace, et le fait que les glaçons que l'on
sort du congélateur soient blancs car pleins de bulles d'air qui se forment lorsque l'air dissous dans l'eau se dégage sous forme de bulles
quand l'eau gèle (la glace ne peut pas contenir d'air dissous). Les espaces vides en question sont 10 000 fois plus petits que ces bulles
d'air micoscopiques
Suite : explication des changements d'états.
L'image ci-dessus correspond à un carré de dimensions réelles 20 nm de côté
(1 nm = 10-9m = 1 millionième de millimètre).
Il s'agit d'un échantillon de silicium, matériau semi-conducteur, ce qui permet au microscope à effet
tunnel de fonctionner.
Chaque atome est clairement discernable sous la forme d'une petite tache ronde blanche.
On voit apparaître des rangées caractéristiques de l'ordre cristallin de l'état solide.
On voit que les atomes sont en contact, ce qui est lié à l'incompressibilité et à la grande densité de l'état solide.
Dans un liquide, les atomes (ou molécules, constituées d'un faible nombre d'atomes) se touchent,
mais peuvent se déplacer les uns par rapport aux autres. Les liquides sont donc également incompressibles et de grande densité mais peuvent s'écouler.
Dans un gaz, les atomes (ou molécules) sont loins les uns des autres, et les gaz sont peu denses et compressibles.
On emploie ici indifféremment le terme d'atomes ou de molécules. Les molécules sont formées d'un assemblage d'atomes. Certains corps comme
l'hélium, sont constitués d'atomes seuls qui ne se relient pas pour former des molécules. Mais pour ce qui concerne ici le comportement collectif,
on pourra considérer les atomes ou molécules comme de petites sphères rigides.